|
蛋白质的构象
01.稳定蛋白质三维结构的力 主要是弱作用力:氢键、范德华力、疏水作用力、离子键
也有共价键:二硫键(半胱氨酸)
02.肽键是刚性平面 两个二面角的概念:
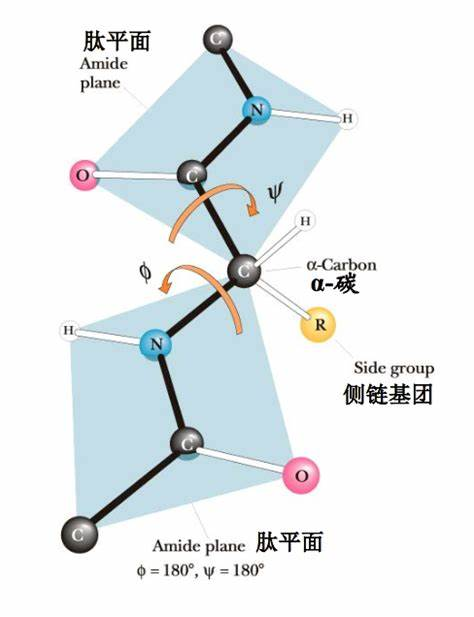
03.蛋白质的二级结构 ①蛋白质二级结构的定义: 肽链的主链在空间的排列,或者规则的几何走向、旋转以及折叠。 ②维持蛋白质二级结构的主要作用力: 氢键,还有部分的范德华力。 ③α-螺旋

α-螺旋的特点: 1.右手螺旋; 2.每3.6个氨基酸旋转一周,螺距为0.54nm; 3.相邻两个螺旋之间形成链内的氢键,是稳定α-螺旋的主要作用力。
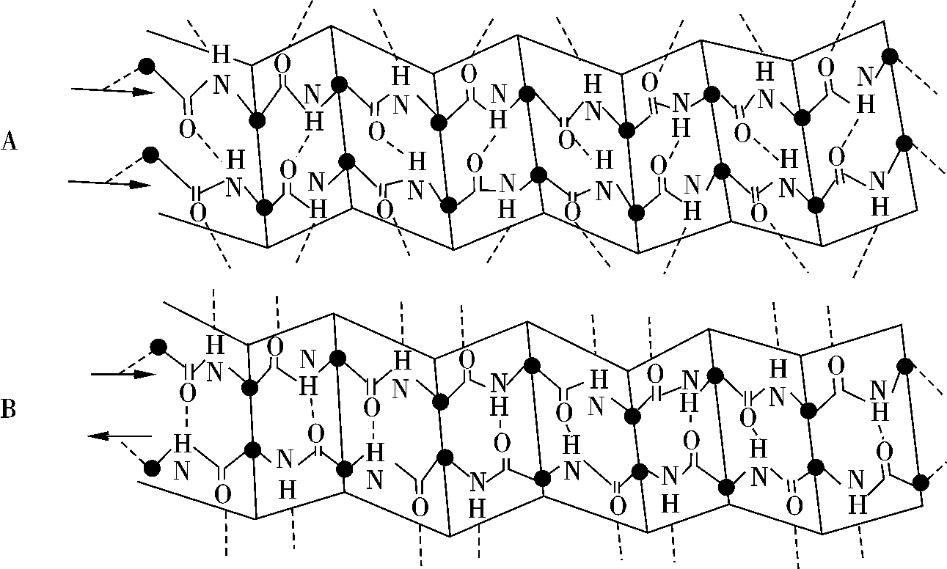
④β-折叠 β-折叠的特点: 1.肽键平面呈锯齿状排列,侧链R基交错分布在两侧;2.由键内氢键维持结构稳定;3.有平行式与反平行式两种类型。 ⑤β-转角 多在球状蛋白质中存在,可以使多肽链的构象发生改变。
04.蛋白质的超二级结构—结构域 超二级结构,又称模体(motif),是指肽链折叠中形成的二级结构的组成方式。主要有三种组合方式: ①αα组合 αα组合是两股或者三股右手α螺旋彼此缠绕而形成的左手螺旋,常见于α-角蛋白和胶原蛋白中。 ②βαβ组合 βαβ组合由三段平行式的β链和二段α螺旋组成,称为Rossmann折叠。 ③ββ组合 ββ组合有两种样式:β曲折和回形拓补结构(希腊钥匙)。
05.蛋白质的三级结构 整个多肽链在二级结构、超二级结构和结构域的基础上盘旋、折叠,形成的特定的整个空间结构。蛋白质三级结构的特点: a.许多在一级结构上相距很远的氨基酸在三级结构上相距很近。 b.球状蛋白质的三级结构很紧实,大部分的水分子从球状蛋白质的核心中被挤出。 c.大的球状蛋白质常常含有多个结构域。
06.蛋白质的四级结构 ①寡聚蛋白是相同或者不同的多肽链相互作用形成的蛋白质,其每个多肽链称为该蛋白质的亚基。 ②空间排布的几何形状,一般为球状。 ③稳定蛋白质四级结构的作用力是肽链间的非共价键。
07.蛋白质的折叠 ①一级结构决定高级结构,即蛋白质的氨基酸序列决定了蛋白质的立体结构。 ②蛋白质折叠是热力学有利的过程,蛋白质折叠朝向自由能最小的方向。 ③折叠中辅助的蛋白质: a.顺反异构酶:肽基脯氨酰异构酶,二硫键异构酶 b.分子伴侣
/扫码一键添加课程顾问 了解课程详细情况/ ⬇️
|